| 产品名称 : | PH0539-EO | Annexin V-FITC/PI 凋亡检测试剂盒 Annexin V-FITC/PI Apoptosis Kit |
| 产品品牌 : | 飞净 PHYGENE |
实验原理
Annexin V 是一种钙离子依赖性磷脂结合蛋白,与磷脂酰丝氨酸 (PS) 有高度亲和力。当细胞发生凋亡时,膜内侧的磷脂酰丝氨酸 (PS) 外翻到膜表面,而被荧光染料 FITC 标记的 Annexin V 结合,可通过流式细胞仪或荧光显微镜进行检测。由于凋亡晚期或坏死细胞膜丧失完整性,而碘化丙啶(Propidium Iodide, PI)可与双链 DNA 特异性结合并产生强烈的荧光,与 Annexin V 搭配使用,可区分处于不同凋亡时期的细胞。
细胞凋亡早期改变发生在细胞膜表面,这些细胞膜表面的改变之一是磷脂酰丝氨酸(PS)从细胞膜内转移到细胞膜外,使 PS 暴露在细胞膜外表面。PS 是一种带负电荷的磷脂,正常主要存在于细胞膜的内面,在细胞发生凋亡时细胞膜上的这种磷脂分布的不对称性被破坏而使 PS 暴露在细胞膜外。Annexin V 具有易于结合到磷脂类如 PS 的特性,对 PS 有高度的亲和性。因此,该蛋白可充当一敏感的探针检测暴露在细胞膜表面的 PS。PS 转移到细胞膜外不是凋亡所独特的,也可发生在细胞坏死中。两种细胞死亡方式间的差别是在凋亡的初始阶段细胞膜是完好的,而细胞坏死在其早期阶段细胞膜的完整性就破坏了。因此,可以采用 Annexin V 与 PI 双染的方法,通过流式检测细胞早期凋亡。
|
产品名称 |
20T |
50T |
100T |
200T |
保存 |
|
Annexin V-FITC Reagent |
100μL |
250μL |
500μL |
1mL |
2-8℃保存,避光 |
|
PI Reagent |
100μL |
250μL |
500μL |
1mL |
2-8℃保存,避光 |
|
Annexin V Binding Buffer(10×) |
3mL |
6mL |
12mL |
24mL |
2-8℃保存,避光 |
运输与保存:冰袋运输,2~8℃保存,有效期12个月。
操作步骤:
试剂配制:1×Annexin V Binding Buffer:取 1 mL Annexin V Binding Buffer (10×)加入 9 mL 去离子水中混匀。
一步法
1. 细胞按照实验方案进行凋亡诱导,300 ×g 离心 5 min,弃上清,收集细胞,PBS 洗涤一次,轻轻重悬细胞并计数。
2. 取 1~5 × 105 重悬的细胞,300 ×g 离心 5 min,弃上清。用 PBS 洗涤细胞一次,离心后弃上清,加入 500 μL 稀释的 1 × Annexin V Binding Buffer 重悬细胞。
3. 细胞悬液中加入 5 μL 的 Annexin V-FITC Reagent 和 5 μL 的 PI Reagent。
4. 轻柔涡旋混匀后,室温避光孵育 15~20 min。
5. 立即上机检测。如不能及时检测,请于冰上避光静置并于 1 小时内完成检测。
注:流式细胞仪检测时 Annexin V-FITC 可用 FITC 通道,PI 优先选择 PerCP/Cy5.5 通道,其次是 ECD 通道。
两步法
1. 细胞按照实验方案进行凋亡诱导,300 ×g 离心 5 min,弃上清,收集细胞,PBS 洗涤一次,轻轻重悬细胞并计数。
2. 取 1~5 × 105 重悬的细胞,300 ×g 离心 5 min,弃上清。用 PBS 洗涤细胞一次,离心后弃上清,加入 100 μL 稀释的 1 × Annexin V Binding Buffer 重悬细胞。
3. 细胞悬液中加入 2.5 μL 的 Annexin V-FITC Reagent 和 2.5 μL 的 PI Reagent。(由于两步法分辨率更高,染色液用量减半依然可得到媲美一步法的效果;用户亦可根据自己的模型进行滴定后加入适量的染色液,用更少的量获得高质量的结果。)
4. 轻柔涡旋混匀后,室温避光孵育 15~20 min。
5. 加入 400 μL 稀释的 1 × Annexin V Binding Buffer,混匀样本。
6. 立即上机检测。如不能及时检测,请于冰上避光静置并于 1 小时内完成检测。
注:流式细胞仪检测时 Annexin V-FITC 可用 FITC 通道,PI 优先选择 PerCP/Cy5.5 通道,其次是 ECD 通道。
注意事项
1. 本产品仅供科研使用。
2. 检测贴壁细胞时,需收集诱导凋亡后产生的悬浮细胞,并与后续收集的贴壁细胞一起检测。
3. 应尽量避免消化贴壁细胞带来的机械损伤。同时,胰酶的消化液中应尽量不含 EDTA,因为 EDTA会影响 Annexin V 与磷脂酰丝氨酸的结合。
4. 如果使用含 EDTA 的胰酶,收集细胞后应充分清洗,确保 EDTA 被去除干净。
5. 染色后宜尽快检测,时间过长可能会导致凋亡或坏死细胞的数量增加。
6. 荧光物质均易发生淬灭,在进行荧光观察时,尽量缩短观察时间,同时在操作和存放过程中也尽量注意避光保存。
7. 为了您的安全和健康,请穿实验服并戴一次性手套操。
实验结果分析:
典型的实验中,细胞可以分成三个亚群,活细胞仅有很低强度的背景荧光,早期凋亡细胞仅有较强的绿色荧光,晚期凋亡细胞有绿色和红色荧光双重染色。
Annexin V-FITC/PI 凋亡检测常见问题:
1、Annexin V/ PI 凋亡检测的试剂盒能否检测人以外其他动物的细胞凋亡情况?
可以。因为 Annexin V 是与磷脂酰丝氨酸(PS)亲和,而 PS 在不同种属间没差异。在正常细胞中,PS 只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,PS 由脂膜内侧翻向外侧。
2、贴壁细胞做凋亡用胰酶消化下来对细胞膜损伤?
低浓度胰酶消化,轻柔吹打贴壁细胞 2~3 次,离心机 4℃1000rpm 5min 离心,处理得当的话,胰酶造成损伤可以控制在 5%以内,有对照组的情况下对实验结果不会造成明显影响。
3、贴壁细胞可以先染 PI 然后再消化下来吗?这样是否可以减小由于消化液造成的细胞膜破损而染上的 PI 的误差?
先加 PI 不仅染色是否每组都均匀充分很难判断,而且 PI 本身对细胞也是有毒性的,对实验结果影响会比胰酶大,不建议这样做。
4、为什么只能用不含 EDTA 的胰酶消化贴壁细胞,用含 EDTA 的胰酶消化细胞对结果有什么影响?
因为 Annexin V 是 Ca 依赖的蛋白,所以不能加入 EDTA,防止 EDTA 螯合了 Ca 离子从而影响 Annexin V,进而影响结果。
常见问题:
Q:Annexin V 凋亡检测试剂盒的原理是什么?
A:Annexin V 是一种钙离子依赖性磷脂结合蛋白,与磷脂酰丝氨酸 PS 有高度亲和力,可通过细胞外侧暴露的 PS 与凋亡早期细胞胞膜结合,将 Annexin V 标记荧光染料如 FITC 利用流式细胞仪或荧光显微镜可检测细胞凋亡。
碘化丙啶(Propidium Iodide, PI)或 7-AAD 可与双链 DNA 特异性结合,并产生强烈的荧光,正常情况下无法透过细胞膜。由于凋亡晚期或坏死细胞膜丧失完整性,核染料 PI 或 7-AAD 可进入细胞内对 DNA 进行染色,与 Annexin V 搭配使用,可区分处于不同凋亡时期的细胞。
Q:Annexin V 凋亡检测结果如何看?
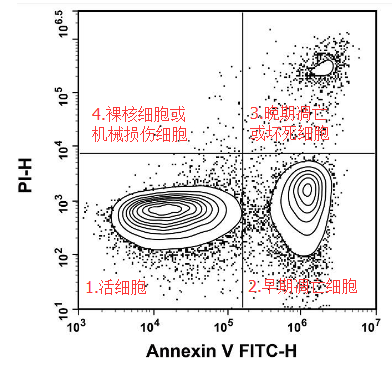
A:
1.Annexin V-PI- —真正的活细胞,Annexin V 和 PI 都无法染上;
2.Annexin V+PI- —细胞只有PS外翻,细胞膜完整,PI 无法染上,此时的细胞为早期凋亡细胞,如果撤走凋亡诱导条件,凋亡可能逆转;
3.Annexin V+PI+ —PS外翻,细胞膜已经受损,PI 染料可以进入细胞内与 DNA 结合,此时细胞为晚期凋亡或坏死细胞,凋亡不可逆;
4.Annexin V-PI+ —细胞发生机械损伤,PI 可以进入细胞,PS 没有外翻,Annexin V 无法染上或者细胞失去细胞膜成为裸核细胞;
Q:如何统计凋亡细胞数?
Annexin V 凋亡实验在做凋亡统计时一般统计细胞早期凋亡率,也有文献统计总的凋亡比例(早期凋亡和晚期凋亡或坏死细胞之和)。
Q:血液样本是否可以用于凋亡检测?
A:如果样品来源于血液,请务必除去血液中的血小板。因为血小板含有 PS,能与 Annexin-V 结合,从而对实验结果产生干扰。
Q:检测凋亡用的细胞能否固定?
A:甲醛固定液会造成结果假阳性,因此用于 Annexin V 凋亡检测的细胞不能进行固定。
需要注意的是,Annexin V 检测的样本为外周血时,勿使用含有多聚甲醛等固定液成分的红细胞裂解液来处理细胞。
Q:有没有更好的办法处理贴壁细胞,来做流式凋亡实验?
A:检测贴壁细胞时,若消化时间不易控制,建议用 Accutase 细胞消化液,对细胞损伤小且不会改变细胞膜上 PS 的分布。
Q:Annexin V 系列有很多种不同组合试剂盒,该如何选择?
A:第一步考虑流式细胞仪配置,第二步考虑细胞自发荧光。对于本身有荧光的细胞(如转染了荧光蛋白基因的细胞或者药物孵育的细胞),特别是培养时间久或药物处理的细胞,一定要注意细胞代谢物和药物的荧光。一般来说,细胞代谢物的荧光会干扰 FITC/PE,所以建议用 Annexin V-APC,药物的干扰可查看药物本身的发射光谱是否会对检测选择的染料有影响。Annexin V-APC 与 7-AAD 两种染料之间补偿干扰很小,染色操作简单,实验准确。7-AAD 染料相比于 PI 染料粘稠度小,可减少检测时样本之间干扰。
Q:说明书上写细胞量为 1~5 × 105 ,细胞量多的话对检测结果有没有影响?
A:建议细胞量最多不要超过 106个,过量的细胞相当于染料被稀释,影响染色和分离效果。一般 2×105 个细胞足够进行凋亡检测了,通常情况下检测 10,000 个细胞就能得到比较好的结果。
Q:是否可以用 PBS 替代凋亡试剂盒里面的 Binding Buffer?
A:不行,Binding Buffer 是必须要加的,Annexin V 与 PS 的结合依赖 Ca2+,Binding Buffer 含有 Ca2+,主要是促进Annexin V 与 PS 的结合。不加 Binding Buffer,会导致 Annexin V 的结合能力降低,造成阳性信号大幅下降甚至无阳性信号。
Q:如何设置补偿管?
A:实验设计时,考虑到补偿,建议设置全单染管调节补偿,如果样本有明显的自发荧光,且自发荧光对选择的染料有干扰,则必需设置一管只有自发荧光的细胞管(对于表达荧光蛋白的细胞,不加任何试剂的空白对照组作为EGFP的单阳组;对于有荧光的药物,细胞只加药物处理,作为药物的单阳组),用来调节补偿,以扣除自发荧光对其它通道的干扰。
Q:染色完不能及时上机,样本能否固定?
A:细胞染色完成后,禁止固定,尽快检测,如无法立即检测,可将样本管放冰上,以减少外界环境对检测结果的影响,Annexin V 结合不稳定,请务必在标记结束后半小时内检测。如果实验室距离上机的地方较远,建议将细胞和试剂盒带到上机的地方,染色后立即检测。
Q:凋亡检测中如何设置对照组?凋亡检测时细胞全部检测都是阳性是什么原因?
A:Annexin V 凋亡检测中,阴阳性的界定不是依据空白组(细胞中不加 PI 也不加 Annexin V),而且依据阴性对照组(细胞不经过药物处理,但是加入 PI 和 Annexin V)。这是因为一般情况下,凋亡检测中,加入 PI 和 Annexin V 之后是不洗涤的,这意味着溶液有本底的荧光,阴性对照的信号肯定是比空白组要高的,如以空白组定阴阳性界限会出现大量假阳性细胞,而以阴性对照组来定阴阳性界限是更符合逻辑的方式。
温馨提示:1.本产品仅供科研使用。请勿用于医药、临床诊断或治疗,食品及化妆品等用途。请勿存放于普通住宅区。2.为了您的安全和健康,请穿好实验服并佩戴一次性手套和口罩操作。3.实验结果可由多种因素影响,相关处理只限于产品本身,不涉及其他赔偿。
-


PH0713 | Tris碱 三羟甲基氨基甲烷 TRIS/Tris-base/THAM CAS:77-86-1
¥70
-


PH0501 | 牛血清蛋白V(Bovine Serum Albumin BSA)CAS号:9048-46-8
¥50
-


PH1519 | 封闭用脱脂奶粉 Skimmed Milk Powder
¥60
-


PH1812 | 1×PBS缓冲液(0.01mol/L, pH7.2-7.4) 1×PBS Buffer
¥60
-


PH0328 | Lowry蛋白定量试剂盒 (Lowry Protein Assay Kit)
¥200
-


PH0996 | 10%中性固定液 / 10% Neutral Fixative
¥25
-


PH0516 | 苏木素伊红(HE)染色试剂盒 Haematoxylin Eosin (H&E) staining
¥180
-


PH0502 | 0.25%胰蛋白酶溶液 胰酶细胞消化液(1×)不含EDTA / 0.25% Trypsin Solut...
¥80
-


PH0337 | 10×Tris-甘氨酸SDS电泳缓冲液 Tris Glycine SDS Running Buffer...
¥140
-


PH1021 | 4%戊二醛固定液 电镜专用 Glutaraldehyde Fixed Solution
¥180



 热线电话
热线电话